Ilmu Kimia berasal dari bahasa Arab, yaitu al-kimia yang berarti perubahan materi, oleh ilmuwan Arab Jabir bin Hayyan (700-778M). Dari kata al-kimia diatas, dapat disimpulkan secara singkat bahwa ilmu kimia berarti: ilmu yang mempelajari rekayasa materi, yaitu mengubah materi menjadi materi lain.
Jadi secara lengkapnya kimia merupakan suatu bagian dari ilmu yang mempelajari tentang sebuah peristiwa atau fenomena yang terjadi di alam, yang mempelajari materi mengenai struktur dan sifat materi(zat), perubahan materidan energi yang turut serta dalam perubahan suatu zat atau materi tersebut.
Ilmu kimia merupakan ilmu yang mempelajari tentang komposisi, struktur, sifat dan perubahan dari suatu zat. Ilmu ini akan erat kaitannya dengan permasalahan-permasalahan sifat suatu unsur dan atom, bagaimana pembentukan suatu senyawa, bagaimana atom berikatan satu dengan lainnya, apa kegunaan dari suatu material, bagaimana reaksi yang dapat dimanfaatkan dalam kehidupan manusia.
Oleh karena luasnya bahasan dalam ruang lingkup kimia, ilmu kimia seringkali dikatakan sebagai central sains atau pusat dari ilmu pengetahuan dikarenakan merupakan dasar ilmu pengetahuan pada ilmu apapun, seperti biologi, fisika, geologi bahkan astronomi berkaitan dengan kimia.
Perkembangan Ilmu Kimia
a. Sekitar tahun 3500 SM, di Mesir Kuno sudah mempraktekkan reaksi kimia (misal : cara membuat anggur dan pengawetan mayat).
b. Pada abad ke-4 SM, para filosofis Yunani yaitu Democritus dan Aristoteles mencoba memahami hakikat materi.
• Menurut Democritus, setiap materi terdiri dari partikel kecil yang. disebut atom.
• Menurut Aristoteles, materi terbentuk dari 4 jenis unsur yaitu : tanah, air, udara dan api.
c. Abad pertengahan (tahun 500-1600), yang dipelopori oleh para ahli kimia Arab dan Persia.
• Kimia lebih mengarah ke segi praktis. Dihasilkan berbagai jenis zat
seperti : alkohol, arsen, zink asam iodida, asam sulfat dan asam
nitrat.
d. Abad ke-18, muncul istilah Kimia Modern. Dipelopori oleh ahli kimia
Perancis Antoine Laurent Lavoisier (tahun 1743-1794) yang berhasil
mengemukakan hukum kekekalan massa.
e. Tahun 1803, seorang ahli kimia Inggris bernama John Dalton (tahun
1766-1844) mengajukan teori atom untuk pertama kalinya. Sejak itu,
ilmu kimia terus berkembang pesat hingga saat ini.
Kimia fokusnya mempelajari tentang materi
• Materi (zat) adalah segala sesuatu yang mempunyai masa dan volume.• Semua benda (besar atau kecil) terbentuk dari materi
• Zat adalah suatu materi yang mempunyai sifat-sifat sama pada seluruh. maupun sebagian kecil dari materi tersebut
• Sifat adalah tabiat yang menjadi ciri-ciri suatu zat tertentu.
Materi tersusun atas partikel-partikel, antara partikel satu dengan yang lain terdapat jarak/kerapatan.
Perbedaan kerapatan menentukan wujud suatu materi
MENGELOMPOKKAN SIFAT-SIFAT MATERI
Materi (zat) adalah suatu yang menempati ruang dan mempunyai masa dan volume. Batu, kayu, daun, padi, air, udara, merupakan beberapa contoh materi.
•Sifat Ekstensif : sifat materi yang bergantung pada jumlah dan ukuran zat, misal nya volume, massa dan berat.
•Sifat Intensif : sifat materi yang tidak bergantung pada jumlah ukuran zat, misalkan warna, bau, membeku, mencair, melarut, menguap dan menyumblim.
Pengembangan Teori Atom dan Modelnya
A. Teori Atom Dalton
Teori atom Dalton adalah teori mengenai atom yang dikemukakan oleh ilmuwan berkebangsaan Inggris, John Dalton. Pada tahun 1808. Teori atom Dalton adalah teori paling tua mengenai penjelasan tentang atom. Dalton menjelaskan bahwa atom merupakan suatu zat yang tidak bisa dibagi – bagi lagi.
Toeri atom dalton merupakan teori atom pertama yang dikemukakan oleh John Dalton (1808), seorang fisikawan asal Inggris. Dalam mengemukakan teorinya terkait struktur atom yang berdasarkan penelitian yang dikemukakannya dalam A New System of Chemical Philosiphy. Dimana john Dalton menjelaskan bahwasanya atom merupakan suatu zat yang tidak dapat dibagi lagi dan merupakan struktur terkecil dari suatu materi.
Model atom Dalton
B. Teori Atom Thomson
Setelah teori atom Dalton muncul dan mulai berkembang pada tahun 1903. Hal tersebut memicu para ilmuan lain pun mulai meneliti terkait struktur atom dengan berbagai penerapan dan percobaan setiap peneliti. Salah satunya adalah J.J Thomson.
Dengan menggunakan hasil penelitian dan penemuan tabung katode oleh William Crookers. Kemudian J.J Thomson pun mulai meneliti terkait sinar katode yang mampu menggerakan baling-baling dalam percobaan tabung katode. Dari hasil percobaan tabung katode tersebut dapat dipastikan bahwa sinar katode merupkan salah satu perikel penyusun dalam atom yang bermuatan negatif.
Dengan hasil percobaan dan penelitian terkait struktur atom yang dilakukan oleh Thomson. Maka, Thomson pun menyatakan bahwa “Atom merupakan bola pejal yang bermuatan positif dan didalamya tersebar muatan negatif elektron”. Dimana, hasilnya disebut model atom roti kismis.
Model atom Thomson
C. Teori Atom Rutherford
Berlanjut ke teori atom Rutherford. Memasuki tahun 1903 seorang peneliti dengan percobaan yang dilakukannya menyatakan bahwa teori atom yang dipaparkan oleh J.J Thomson belum tepat.
Mendengar hal tersebut mendorong Ernest Rutherford (1911) untuk melakukan percobaan untuk mencari struktur atom yang benar. Dengan bantuan dari kedua muridnya Hans Geiger dan Ernest Marsden. Rutherford melakukan eksperimen dengan menembakkan sinar alfa ke sebuah lepengan emas dengan partikel alfa yang percobaan ini dikenal dengan percobaan Geiger-Marsden. Saat melakukan tembakan sinar ke lempengn tersebut. Rutherford menemukan bahwa sinar alfa yang ditembakkan menghasilkan sinar yang dibelokkan, dipantulkan, dan diteruskan.
Model atom Rutherford
D. Teori Atom Niels Bohr
Ditahun 1913, seorang pakar fisikawan asal Denmark dengan nama Niels Bohr menyatakan bahwasanya teori atom dari Rutherford dapat untuk disempurnakan kembali menjadi teori atom yang lebih baik. Dimana, Niels Bohr dengan percobaan yang dilakukan menggunakan teori kuantum dari Planck.
Dari percobaan yang dilakukannya ketika melihat penampakan sinar yang berada disekitar cahaya berupa bola pejal ataupun nyala api bahkan listrik tegangan tinggi. Dari hal tersebut Bohr pun menyempurnakan penelitian dari teori yang diajukan oleh Rutherford. Para ahli kadang memberikan istilah teori atom Rutherford-Bohr.
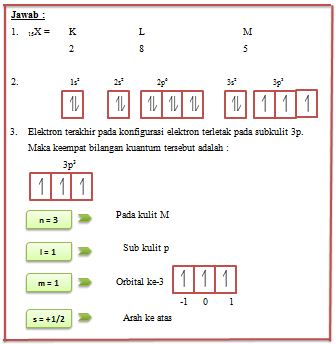
Berdasarkan hasil penelitian yang dilakukannya. Bohr pun mengemukakan teori yang di milikinya yang menyebutkan bahwa elektron yang bermuatan negatif berputar mengengelilingi inti atom yang bermuatan atom positif pada jalur lintasanya tersendiri. Dan setiap lintasan elektron yang memiliki orbitnya tersendiri memiliki kekuatannya elektronnya tersendiri.
Dengan elektron terluar merupakan elektron yang paling mudah lepas atau berpindah. Sedangkan, elektron yang paling dekat dengan inti merupakan elektron yang paling sulit untuk berpindah. Ketika elektronakan berpindah dari satu orbit ke orbit lain. Maka, diperlukan suatu energi yang berfungsi untuk memindahkan atau menghandatkan muatan elektron ke lintasan yang lemah atapun menarik ke lintasan yang terdekat dengan inti atom.
Model atom Niels Bohr
Dengan demikian, banyaknya orbit setiap atom dalam tabel periodik memiliki nilai tersendiri dan mempengaruhi banyaknya jumlah elektron pada setiap orbit tersebut. Namun, pada teori atom Bohr ini masih terdapat kekurangan yang sampai sekarang masih berusaha untuk disempurkana oleh setiap ilmuan yang ada.
Daftar pustaka :
https://www.gurupendidikan.co.id/ilmu-kimia/
https://enjiner.com/struktur-atom/
Sumber foto :
kokimia.com
mfyeni.wordpress.com
Laboratoria.com
wikipedia.com
wikimedia.com
Enjiner.com
Sekian dan terima kasih. Semoga bermanfaat ya teman-teman:)